添加微信mede1917
或扫描二维码

添加微信mede1917
或扫描二维码

欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构


 美联医邦
美联医邦
文章类型: 肺癌
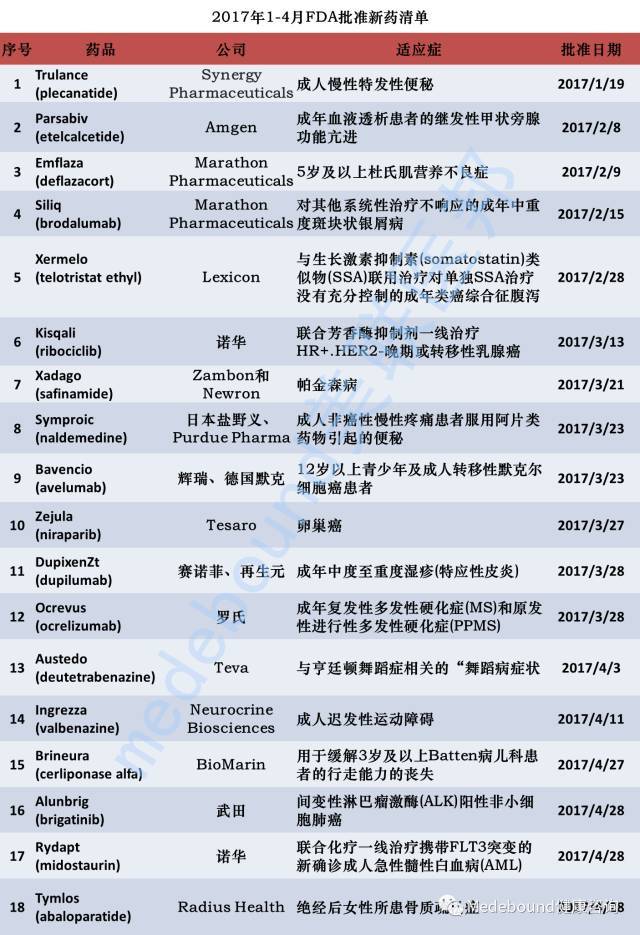
FDA获批的新药反映着最前沿的医疗发展趋势。从获批新药中我们能够了解到某种疾病目前最先进的治疗方法。5月,出国看病服务机构了解到FDA药品评价与研究中心共批准438个项目,包括新药、仿制药及药物的扩大适应症申请,疾病类型涵盖风湿性关节炎、非小细胞肺癌等等。
2017年5月初,小美为大家总结了2017年1-4月份的FDA批准的新药,其中包括12年来首个获批用于治疗透析患者继发性甲状旁腺功能亢进的Parsabiv (etelcalcetide);首个用于治疗杜氏肌营养不良症患者的皮质类固醇药物Emflaza (deflazacort);以突破性药物和优先审评通道获批用于治疗HR+/HER2-晚期或转移性乳腺癌的Kisqali (ribociclib);十多年来首个用于治疗帕金森病的新化学实体药物 Xadago (safinamide)等等18种药物。
关注“medebound健康咨询”微信公众号,了解最新的FDA药物资讯,我们不定期为大家更新美国最新FDA药物。
五月,出国看病服务机构了解到FDA药品评价与研究中心(CDER)在五月共批准了438项药品,包括新药、仿制药以及某些药物的扩大适应症的补充申请。(438项,小美不得不感叹下,美国药品的发展真是惊人,平均每天批准约15个项目,这背后显示出的美国医疗的创新的实力得多强呀,原有药物也在不断拓展,来扩大其临床适应症)。
五月共批准了三个新药,分别是再生元与赛诺菲共同研发的Kevzara(sarilumab)、MT Pharma America公司的Radicava(edaravone)以及上一周小美给大家介绍的第五款PD-1/PD-L1药物阿斯利康的Imfinzi(Durvalumab)。

1. Kevzara
5月22日,FDA批准了由再生元与赛诺菲合作研发的风湿性关节炎新药Kevzara(sarilumab),用于治疗罹患中度至重度风湿性关节炎,且先前接受过疾病缓解性抗风湿药物治疗,但缓解程度不足,或对药物出现耐受的成人患者。值得一提的是,这是由再生元与赛诺菲这对组合带来的第三款抗体新药。

Kevzara(sarilumab)
据估计,风湿性关节炎在全球大约影响了8600万人,超过全球人口的1%。Sarilumab的疗效与安全性在两项关键的3期临床试验中得到了验证。第一项试验是安慰剂+甲氨蝶呤 VS sarilumab+甲氨蝶呤;第二项临床试验是用于分析sarilumab与疾病缓解性抗风湿药物联合治疗的效果。两组试验,在第24周,试验组都抵达了主要临床终点,有显著改善。52周后效果更加明显。此外,试验组患者的运动能力也有改善。
2. Radicava
5月5日,出国看病服务机构了解到FDA批准MT Pharma America的新药Radicava(edaravone)上市,治疗肌萎缩性侧索硬化(ALS),这是美国FDA 22年来批准的首款ALS疗法。Radicava是一款神经保护剂,能强效清理自由基,使神经免于氧化应激和神经元凋亡。此前,它已于日本上市,并曾获得美国FDA颁发的孤儿药资格。

Radicava(edaravone)
ALS以“渐冻人症”之名为人所熟知,它是一种罕见的渐进性神经退行性疾病。此前广受关注的冰桶挑战即是唤起关注 ALS 的慈善活动。由于这种疾病的渐进性特性,患者的症状会不断恶化。据估计,大部分患者会在症状首次出现的 3-5 年内由于呼吸衰竭而死亡。
Radicava的批准是基于一项于日本进行的为期6个月的临床试验。137名患者被随机分为两组,出国看病服务机构了解到一组接受edaravone,一组接受安慰剂。在研究的第24周,与对照组相比,接受edaravone治疗的患者日常运动能力的下降幅度更低。基于这一结果,FDA批准edaravone上市。
3. Imfinzia
在上一周的文章当中小美有给大家介绍Imfinzi,出国看病服务机构了解到它是第五个获批的PD-1/PD-L1药物,重要的事情说三遍,这里小美给大家说第二遍。
5月1日, FDA加速批准 了英国和瑞士阿斯利康公司的Imfinzi(Durvalumab)用于治疗治疗局部晚期或转移性尿路上皮癌。适用于以含铂类药物化疗或化疗后疾病进展的患者,或在术前术后以含铂类药物化疗的12个月内疾病进展的患者。

Imfinzi(Durvalumab)
除了新药之外,出国看病服务机构了解到5月FDA批准同时批准了许多药物扩大适应症申请,以及一些仿制药申请。比如,批准第一个仿制版本的Strattera用于治疗注意力缺陷/多动症(ADHD)的儿童和成年患者、Zykadia用于一线治疗ALK突变阳性的一线转移性非小细胞肺癌(NSCLC)的扩大治疗等等。
4. Strattera
5月30日,FDA批准了第一个仿制版本的Strattera (atomoxetine),用于治疗注意力缺陷/多动症(ADHD)的儿童和成年患者。Strattera本身由美国制药巨头礼来(Eli Lilly)研制,这次批准的仿制药来自Apotex 公司,梯瓦(Teva)美国公司,奥罗宾多(Aurobindo)和马克(Glenmark),有多种剂量规格。被FDA批准的仿制处方药物与品牌药物有相同高质量和强度。仿制处方药物制造和包装地点必须通过与品牌药物相同质量标准

Strattera (atomoxetine)
美国FDA药物评价及研究中心仿制药办公室主任Kathleen Uhl医师表示,出国看病服务机构了解到首批Stattera仿制药的上市,将为ADHD儿科患者和成人患者群体带来更多的治疗选择,帮助控制其疾病。仿制版处方药的生产和包装必须符合品牌药同样的质量标准。
5. Actemra
5月23日,出国看病服务机构了解到 FDA优先批准了罗氏旗下的基因泰克公司的Actemra(tocilizumab),用于皮下注射治疗巨细胞动脉炎成年患者,成为首个治疗巨细胞动脉炎的药物。

Actemra(tocilizumab)
一项III期临床试验评估了tocilizumab的疗效并支持其通过了审批。这是全球范围内的随机双盲有安慰剂对照的研究,涉及14个国家的251例巨细胞动脉炎患者的研究。结果显示,在最初的6个月联合类固醇(糖皮质激素)治疗中,Actemra能够更有效地维持疗效,该疗法每周一次治疗组的1年缓解率为56%,每两周一次治疗组1年缓解率为53.1%;而安慰剂+6个月类固醇方案组的1年缓解率仅为14%,安慰剂+12个月类固醇方案组的1年缓解率仅为17.6%。
6. Zykadia
5月29日,FDA批准Zykadia(Ceritinib)的新适应症,用于一线治疗ALK突变阳性的一线转移性非小细胞肺癌(NSCLC)的扩大治疗。 Zykadia是辉瑞克唑替尼(crizotinib)之后第2款可用于ALK+NSCLC一线治疗的靶向药物。

FDA批准的ALK+NSCLC靶向药物
Zykadia于2014年首次获得加速批准用于对crizotinib不耐受或疾病进展的ALK阳性的转移性NSCLC的患者治疗。2017年1月,FDA授予了Zykadia突破性疗法认定,用于一线治疗ALK阳性的脑部转移性NSCLC患者,并向ALK阳性转移性NSCLC一线治疗颁发了优先审评资格。
Zykadia的一线疗法获批是基于一项全球范围的开放标签的随机多中心III期临床试验的结果。研究表明,出国看病服务机构了解到Zykadia组患者的中位无进展生存期(PFS)为16.6个月,显著优于使用标准培美曲塞-铂化疗方案后维持治疗患者的8.1个月。Zykadia组脑转移患者的总体颅内缓解率为57%,优于化疗患者的22%。Zykadia组的全身总体缓解率为73%。FDA同时批准了用于检测ALK基因重组的方法来帮助判断患者最合适的治疗方案。
7. Kisqali-Femara
5月10日, FDA批准了诺华制药的Kisqali-Femara组合制剂(ribociclib片剂+letrozole片剂)用于绝经后女性激素受体阳性/人类表皮生长因子受体2阴性(HR+/HER2-)晚期或转移性乳腺癌的治疗。

Kisqali
依据这一批准,医生今后可以灵活的开具含Kisqali的组合处方或Kisqali与任意芳香酶抑制剂的搭配处方。Kisqali在今年3月被批准和芳香酶抑制剂联合用药用于治疗(HR+/HER2-)晚期或转移性乳腺癌。Femara是一种已被批准的用于绝经后妇女HR+或未知的晚期乳腺癌治疗的芳香酶抑制剂。
8. Bavencio
5月10日,FDA批准了默克雪兰诺和辉瑞公司Bavencio(avelumab)用于治疗晚期尿路上皮癌,这些患者之前接受过铂类化疗或者接受铂类化疗作为新辅助治疗或辅助治疗后的12个月内有疾病进展。Bavencio此前已被FDA通过加速审批通道批准用于治疗患有转移性Merkel细胞癌的成人和12周岁及以上的儿童患者。上述适应症的继续批准或取决于验证性临床试验的疗效。

Bavencio(avelumab)
9. Rydapt
5月2日,FDA批准了诺华制药的Rydapt (midostaurin)用于新确诊的带有FLT3突变的急性髓系白血病,并与化学疗法联合用药,即联合标准的阿糖胞苷和道诺霉素疗法和阿糖胞苷巩固疗法。FDA同时批准了Invivoscribe Technologies公司的伴随诊断试剂盒LeukoStrat CDx FLT3用于测定患者的FLT3突变。

Rydapt (midostaurin)
Rydapt也被批准用于成人罕见血液疾病如侵袭性全身性肥大细胞症,出国看病服务机构了解到系统性肥大细胞症与血液学肿瘤或肥大细胞白血病。此次获批是依据两项开放标签的单臂多中心临床试验Rydapt的疗效是建立在确认完全缓解的基础上,加上六个疗程标准治疗的不完全缓解(89名患者)。分析表明整体响应率为21%。其疗效也经由2013 IWG-MRT-ECNM共识标准进行了事后分析(115名患者),其完全或部分缓解率为17%。
10.Alunbrig
5月2日,出国看病服务机构了解到FDA加速批准了武田制药的子公司Ariad Pharmaceuticals的新药Alunbrig用于治疗疾病进展或对crizotinib不耐受患者的ALK阳性突变的非小细胞肺癌。

Alunbrig
此次获批是基于一项非对照的开放标签的双臂临床II期ALTA试验。用药组患者在接受推荐剂量每天90mg持续7天后再使用每天180mg的剂量,其中54%的患者获得了经调查认定的客观应答,中位答应时间为独立评审委员会评估的13.8个月和研究者评估的11.1个月。此外,在推荐剂量方案下的脑转移可测量的患者中,67%(18例)获得经证实的颅内客观应答。在23例发生颅内应答的患者中,78%来自90mg剂量组且其中的68%获得了持续4个月以上的持续缓解。
最后,请大家关注“medebound健康咨询”微信公众号了解最新的FDA药物资讯,我们不定期为大家更新。
参考信息链接:
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm560873.htm
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm559791.htm
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm561096.htm
本文由美联医邦Medebound原创,欢迎转发,未经美联医邦允许,不得转载,违者必究。
部分美联医邦美国名医真实案例:
☞中国还原体肌病患儿获美国专家免费5+小时多学科会诊、免费食宿,感恩遇见美国最高政府卫生研究院
☞膀胱癌患者通过视频会诊中美两国三地联线哈佛名医,出国看病服务机构了解到寻求治疗方案及临床试验建议
微信公众号:medebound

凭借我们30多年的美国医疗网络资源,您可以直接与美国医疗精英对话,在家中咨询美国顶级专家或国际会诊,不出国门获取先进治疗方案。
凭借我们30年的医疗网络资源,您可以直接与美国医疗精英对话。在家中咨询疑难疾病的专家,轻松了解治疗方案。
如需赴美就医或获取海外新药,我们为您一站式安排海外看病等服务。



服务优势
预约知名美国专家譬如安德森癌症医院和梅奥诊所,安排无忧出国看病行程,寻找全球新药新技术医生网络
我们与美国顶级1%的海外医疗医生网络,300+所美国权威医院和药房资源深度合作一站式海外诊疗我们的专属客服医学经理,为您免费咨询,最短时间获取预约优质医疗资源

Jason 王经理
医学客服经理/添加微信:Mede2018

Kiki 圆经理
医学客服经理/添加微信:mede1917






如果您和您的家人有任何医疗和新药需求,请欢迎随时联系我们。我们客服团队工作时间周一到周五早上9点到晚上8点,北京时间。
总部位于纽约,9年专注美国,是赴美就医服务细分领域的头部机构。 始终坚持精英式定制(非保姆式),获30+历史卡思克鲁力医生集团(全美TOP医生联盟)及股东战略产业投资,不涉及风险资本。 作为美国本土医疗资源提供商,美联医邦已与中国平安、泰康人寿、太平人寿等保险集团达成总对总合作。服务覆盖数百万保险客户。美国福布斯榜推荐和英文报道,直通全美前5%顶级专家网络。只精准对接全美72个专科排名TOP3医院,包括梅奥诊所、MD安德森、纪念斯隆-凯特琳癌症中心等百余家美国著名医疗机构。申请美国医院的折扣率10-30%,和美国医院议价能力高。3000+客户的信任选择,一切从用户角度出发,鼓励部分患者远程二诊/问诊拿方案在国内治疗,不过度宣传和劝退不必要的赴美看病。
了解更多美国美联医邦成都运营服务中心
Disclaimer 免责声明:
本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
纽约总部:
260 Madison Ave 8th Floor #8001,New York, NY 10016
美联医邦Medebound北京国际会诊中心:
北京市东城区天坛南里12号医疗机构
美联医邦Medebound成都运营服务中心:
成都市锦江区红星路一段35号A区1号楼605
(美)+1 917-342-2381
(中) +86 400-616-2591
support@medebound.com