导读:氏肌营养不良症(DMD)是一种罕见而严重的遗传性疾病,传统治疗方法的副作用限制了患者的生活质量。瑞士制药公司Santhera Pharmaceuticals近日宣布,其在研药物AGAMREE已成功获得美国食品和药物管理局(FDA)的批准,成为治疗DMD的一项新选择,为患者带来了新的曙光。美联医邦作为拥有8年海外就医服经验的跨境医疗服务机构,在您的求医之路上带来些许帮助。
DMD治疗的现状
多年来,皮质类固醇一直是DMD的一线治疗方法,但其效用受到副作用的限制,包括体重增加、身材矮小和骨密度下降等。对于患有DMD的患者和其家庭而言,治疗这一疾病是一项长期而复杂的任务。因此,寻找更有效且副作用更少的治疗方法一直是医学界的追求目标。

AGAMREE的突破性获得FDA的加速批准
瑞士制药公司Santhera Pharmaceuticals近期宣布,其在研药物AGAMREE口服混悬液40 mg/mL已获得FDA批准,用于治疗2岁及以上的DMD患者。这是一种解离类固醇,旨在保留皮质类固醇的抗炎活性,同时减少不良事件。此次批准基于VISION-DMD研究2b期数据,该研究证明了AGAMREE相对于安慰剂在耐受时间测试(TTSTAND)速度变化方面的优越性。
医学博士Stanley Iyadurai表示:“这项批准为DMD患者引入了一种新颖的替代治疗选择。其独特的结构和作用机制导致可耐受的副作用,且疗效与传统皮质类固醇治疗方案相匹配,并提供了一种极好的替代治疗选择。”
AGAMREE的药物说明
剂型和强度口服混悬液
40毫克/毫升
适应症用于治疗2岁及以上的杜氏肌营养不良症(DMD)患者
剂量和用法6毫克/千克 口服 每日一次,最好在进餐时
体重>50千克:每日不超过300毫克
一些患者可能对每日口服2毫克/千克有反应;根据个体耐受性,可以逐渐调整剂量至每日2毫克/千克
剂量调整与强CYP3A4抑制剂联合用药
将剂量减至每日4毫克/千克;体重>50千克时,不超过每日200毫克
肾功能受损
谨慎使用
肝功能受损
轻度至中度(Child-Pugh A或B):每日2毫克/千克;体重>50千克时,不超过每日100毫克
重度(Child-Pugh C):未研究
根据个体耐受性逐渐调整剂
展望未来
AGAMREE的获批意味着DMD患者将有更多的治疗选择,有望改善他们的生活质量并减轻疾病带来的负担。随着新型治疗方法的不断涌现,DMD领域的研究和发展将进入新的阶段,为患者提供更多创新的医学解决方案。
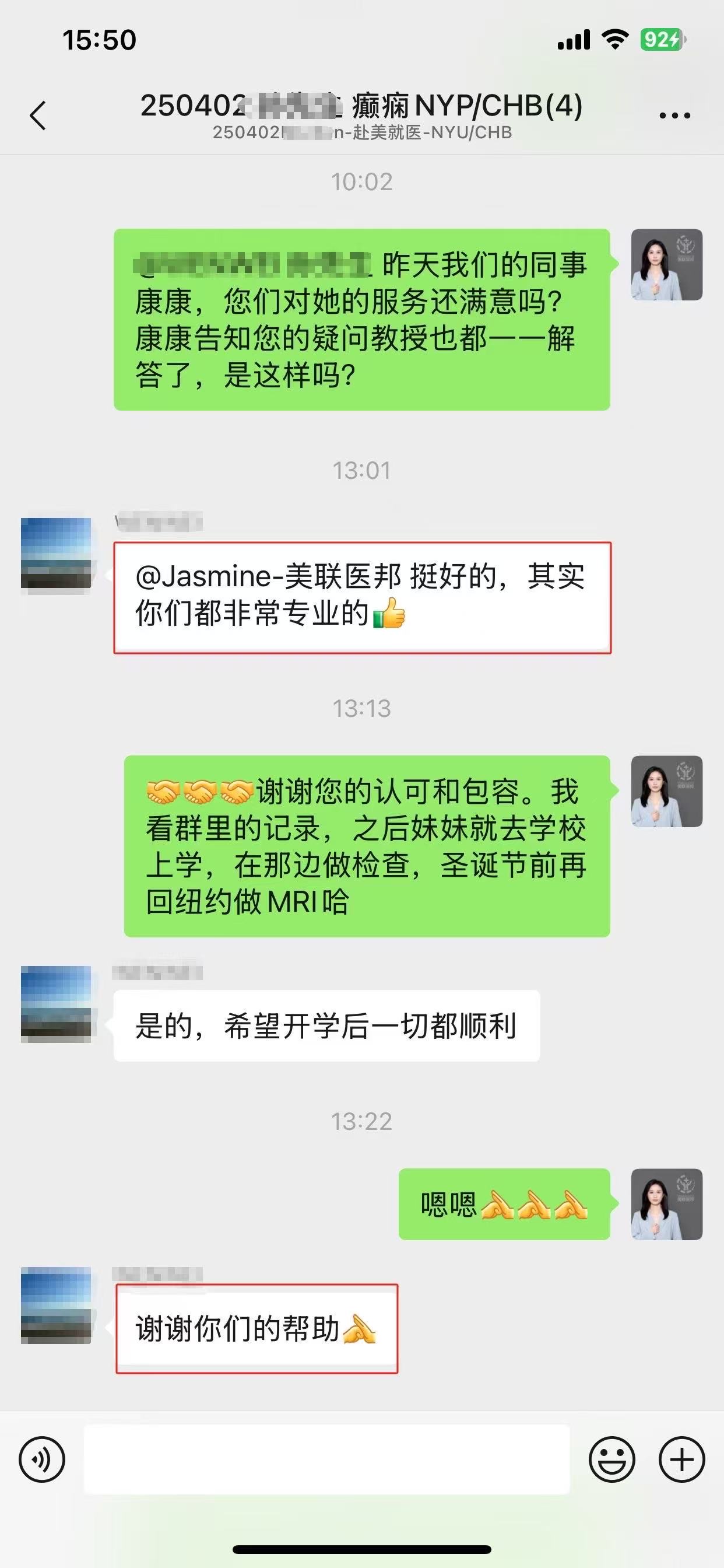
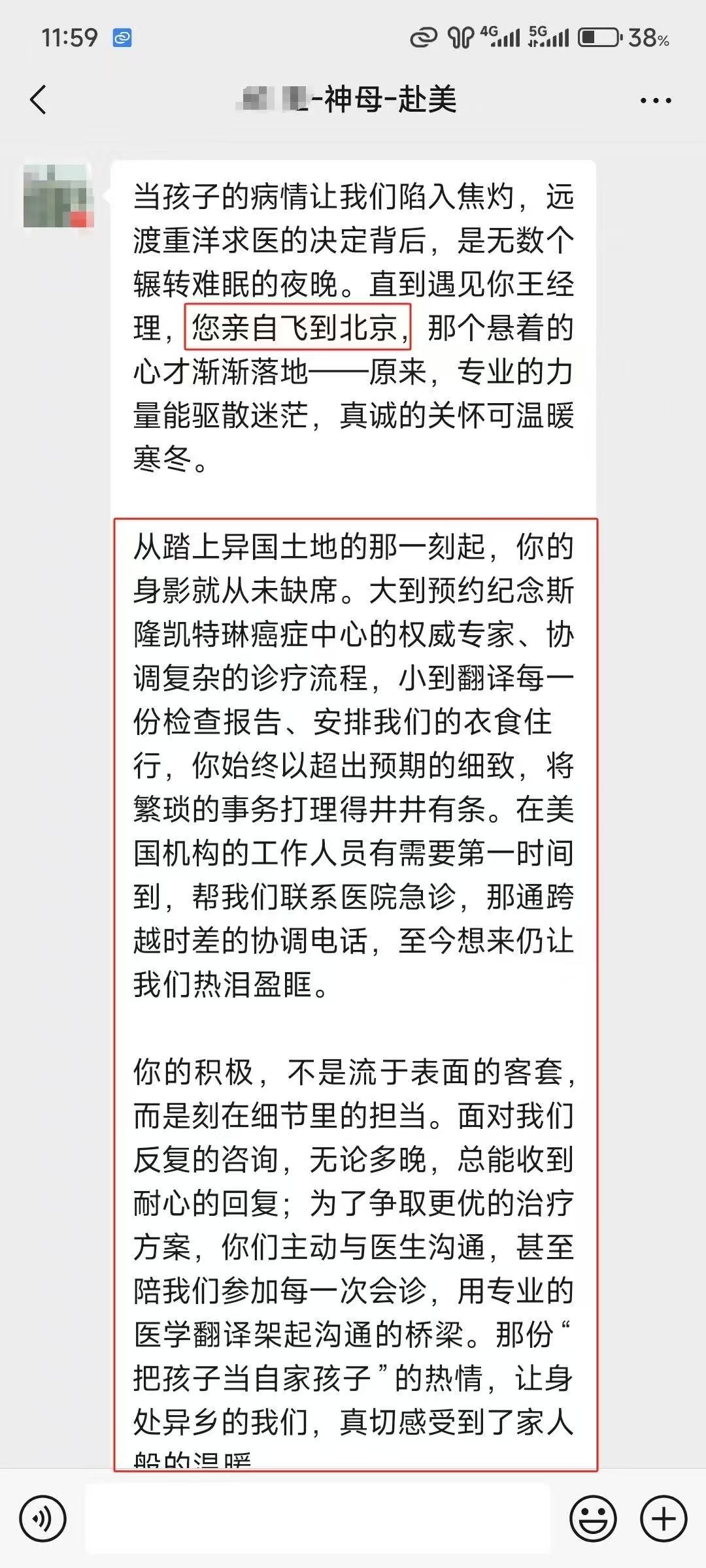
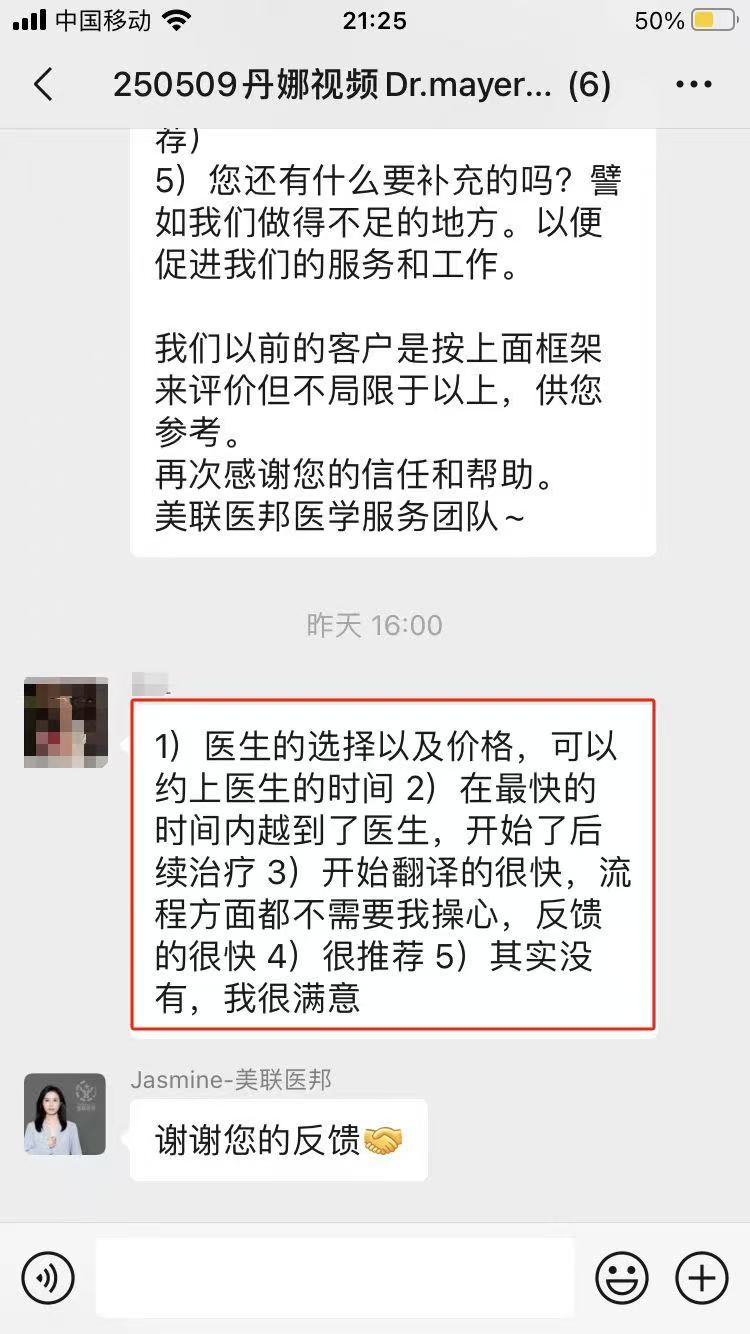
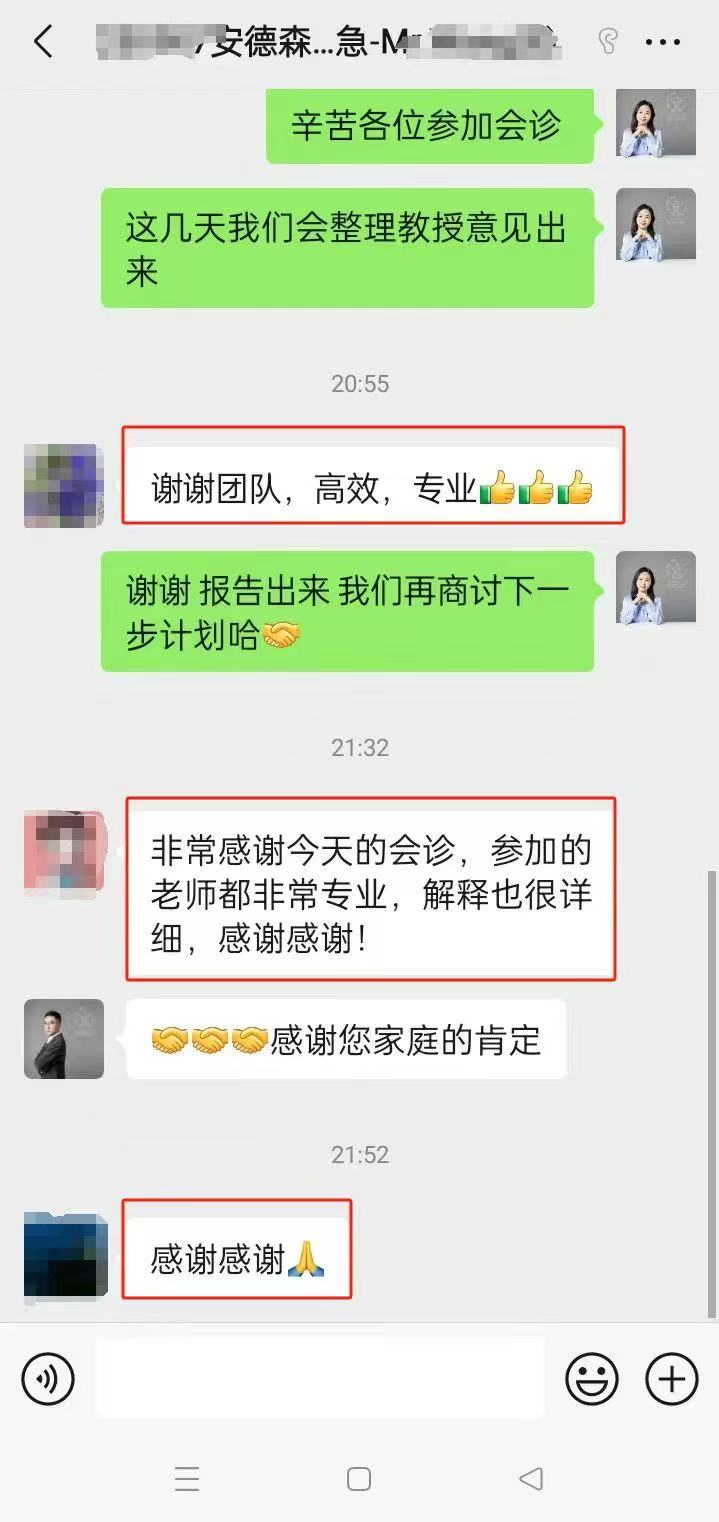
相关服务案例:
▌ 我们可以提供
▪ 收集病史资料,撰写国际转诊病历报告;
▪ 准确选择美国对口医院,快速预约美国专家远程视频会诊;
▪ 会诊后如有出国需求,我们协助患者协助办理签证;对接美国最新疗法;
▪ 争取最大的医疗优惠折扣;
▪ 提供便捷、专业的美国就医陪同和生活陪同服务;
▪ 通畅的中美诊疗信息沟通平台和专业的随访服务。
▌ 联系 · 方式
地址: 北京市东城区天坛南里12号美国MEDEBOUND美联医邦美国会诊中心
客服微信: Mede2018
邮箱: support@medebound.com
全国免费咨询热线: 400-616-2591
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
本文由美国美联医邦Medebound编辑原创,未经美联医邦允许,不得转载,违者必究。美国美联医邦借助其30年历史的美国顶级名医网络,用便捷通道帮助国内患者接触到世界先进治疗方法,开展美国肿瘤罕见病名医视频咨询,出国就医和新药绿通,为生命续航。电话:4006162591,微信公众号:搜索“美联医邦”。

参考材料:
【1】:https://www.startupticker.ch/en/news/santhera-s-agamree-receives-fda-approval-for-duchenne-muscular-dystrophy-treatment
【2】:https://www.neurologylive.com/view/fda-approves-vamorolone-agamree-duchenne-muscular-dystrophy
【3】:https://reference.medscape.com/drug/agamree-vamorolone-4000362
![]()









 美联医邦
美联医邦