添加微信mede1917
或扫描二维码

添加微信mede1917
或扫描二维码

欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构


 美联医邦
美联医邦
文章类型: 美国新药和前沿
导读:2024年5月16日,美国食品和药物管理局(FDA)加速批准了Tarlatamab(Imdelltra, Amgen公司)用于治疗在铂类化疗后疾病进展的广泛期小细胞肺癌(ES-SCLC)成人患者。Imdelltra成为第一个也是唯一一个针对DLL3的双特异性T细胞接合剂治疗方法,Tarlatamab塔拉妥单抗 的上市为小细胞肺癌提供了新的治疗选择。塔拉妥单抗价格多少呢?在哪里能买到? 美联医邦作为拥有9年海外就医服务经验的美国本土出国看病服务机构将为您带来最新讯息,同时分享我们协助国内患者获取美国上市新药的案例。
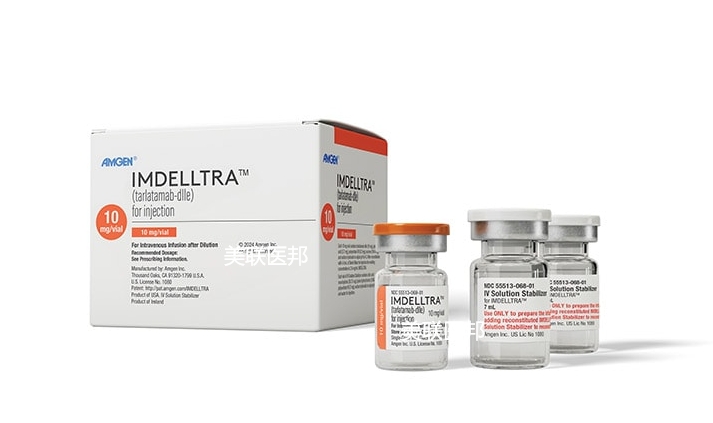
Tarlatamab是一种双特异性T细胞连接器,它通过同时结合癌细胞上的DLL3蛋白和T细胞上的CD3蛋白来帮助人体的免疫系统攻击癌细胞。这种作用将T细胞引导至癌细胞附近,从而触发免疫系统消灭癌细胞。DLL3是一种在大多数SCLC病例中表达的蛋白质(大约85-94%)。Tarlatamab通过靶向DLL3蛋白,使其成为治疗小细胞肺癌的潜在选择。
临床试验中表现与疗效
该批准基于DeLLphi-301试验(NCT05060016)的数据,这是一个开放标签、多中心、多队列的二期研究,旨在评估tarlatamab-dlle在先前接受过治疗的SCLC患者中的疗效和安全性。该试验共招募了99名在铂类化疗后疾病进展的ES-SCLC患者。主要疗效结果包括依据RECIST 1.1标准评估的总体反应率(ORR)和反应持续时间(DOR),由独立中央审查评估。试验结果显示,ORR为40%(95% CI:31, 51),中位DOR为9.7个月(范围2.7, 20.7+)。其中,27名铂耐药性患者的ORR为52%(95% CI 32, 71),42名铂敏感性患者的ORR为31%(95% CI 18, 47)。
在DeLLphi-301试验中,接受10 mg每两周一次的剂量方案的患者显示出显著的抗肿瘤活性和持久的客观反应,且中位总生存期为14.3个月。40%的患者对治疗产生反应,这些反应非常持久,代表了SCLC治疗模式的重大进展。
安全性与不良反应
Imdelltra的处方信息包括对严重或危及生命的细胞因子释放综合征(CRS)和神经毒性的黑框警告,包括免疫效应细胞相关的神经毒性综合征(ICANS)。最常见的不良反应(超过20%)包括CRS、疲劳、发热、味觉障碍、食欲下降、肌肉骨骼疼痛、便秘、贫血和恶心。最常见的3级或4级实验室异常(超过5%)包括淋巴细胞减少、钠减少、尿酸增加、中性粒细胞减少、血红蛋白减少、活化部分凝血活酶时间延长和钾减少。
如何使用Tarlatamab(Imdelltra)
推荐的tarlatamab剂量为第1周期第1天静脉输注1小时的初始剂量1 mg,随后在第1周期第8天和第15天给予10 mg,然后每两周一次,直至疾病进展或不可接受的毒性。
认定为突破性疗法
Imdelltra的申请加速通过基于ORR和DOR的突破表现,该申请还获得了优先审查、突破性疗法认定和孤儿药认定。
对于失败了其他免疫治疗的患者
- 许多参与该试验的患者之前已经接受过化疗和PD1/PD-L1抑制剂(例如nivolumab或pembrolizumab)治疗,但效果不佳。
- 73% 10毫克组患者和70% 100毫克组患者之前接受过PD1/PD-L1治疗。
- 即便如此,Tarlatamab在这些患者中的效果仍然显著,这表明它可能是对于那些对之前免疫疗法无反应的患者的一种可行选择。
对于有脑转移的患者
根据该研究,Tarlatamab在小细胞肺癌(SCLC)患者中进行了测试,且包括一些已经出现脑转移的患者。在试验中,23%的10毫克组患者和36%的100毫克组患者患有脑转移。因此,该药物在这些患者中仍然显示出疗效。
尽管具体的脑转移患者数据未单独详细说明,但整体研究结果显示,Tarlatamab对已经接受过多次治疗且癌症复发的患者,包括脑转移患者,仍然表现出一定的抗肿瘤活性。因此,Tarlatamab可能是一种对有脑转移的SCLC患者有效的治疗选择。
是否需要进行DLL3基因检测?
- 该研究不要求患者进行DLL3阳性检测即可参与。虽然在有可评估样本的患者中,96%检测到了DLL3蛋白,但即便在那些没有DLL3可评估样本的患者中,Tarlatamab的疗效依然得以体现。
- 这意味着,虽然知道你的肿瘤是否表达DLL3可能对治疗效果有更多的指导意义,但DLL3检测可能不是确定是否适合Tarlatamab治疗的必要条件。
以下是我们如何帮助一位国内癌症患者获得美国上市新药的案例:
美联医邦协助了华西医院与安德森医生的顶级会诊,并最终协助患者获得了美国上市新药,为癌症患者带来了新的治疗希望,同时提供了未来治疗规划的重要建议和支持。
来自美联医邦的一段话
随着科技的发展,时代的进步,新兴的医疗技术不再是遥不可及,世界顶级名医的意见能触手可得,国际新上市的药物也能及时获取,身处这个信息互联互通的时代,患者不要飞到国外就可就地得到诊治和获取治疗新药,享受医疗研发的最新前沿,获取新的生存契机。如果你周围患者朋友当在疾病面前犹豫不前时,请向我们伸出援手,美联医邦愿意为之雪中送炭,竭尽全力在所不惜。
▌ 关于申请
如果您或家人不幸被确诊为重大疾病,并且已从其他信息渠道获悉美国有该病的治疗方案、专家、药物、临床研究等医疗资讯,有意出国寻求医疗救治的或者海外新药申请服务的,我们欢迎您病情相关资料。我们美国总部将在第一时间为您对接美国权威专家视频会诊和新药申请服务。美联医邦服务了上千海外国际二诊,美国视频会诊和赴美看病的患者,如有需要请联系我们(400热线:4006162591,电话进来后请告知文章码2018获取专属折扣,客服老师微信:Mede2018)
▌ 关于 · 我们
美国美联医邦Medebound HEALTH 是一家创始在美国,总部位于纽约,并在大陆和香港设有分部的国际医疗公司。 董事会由资深的美国医院领导组成。 我们致力于帮助世界有疑难重疾患者对接到美国顶级医疗资源,专注于开展美国肿瘤罕见病名医的第二诊疗意见,视频咨询,出国就医和美国最新药物申请。 至今美联医邦已经签约中国保险集团总部包括中国平安,泰康,太平人寿等,服务覆盖数百万保险人群。
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。 请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。 本文不用于诊断或治疗疾病,也不影响治疗方案。 美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。

凭借我们30多年的美国医疗网络资源,您可以直接与美国医疗精英对话,在家中咨询美国顶级专家或国际会诊,不出国门获取先进治疗方案。
凭借我们30年的医疗网络资源,您可以直接与美国医疗精英对话。在家中咨询疑难疾病的专家,轻松了解治疗方案。
如需赴美就医或获取海外新药,我们为您一站式安排海外看病等服务。



服务优势
预约知名美国专家譬如安德森癌症医院和梅奥诊所,安排无忧出国看病行程,寻找全球新药新技术医生网络
我们与美国顶级1%的海外医疗医生网络,300+所美国权威医院和药房资源深度合作一站式海外诊疗我们的专属客服医学经理,为您免费咨询,最短时间获取预约优质医疗资源

Jason 王经理
医学客服经理/添加微信:Mede2018

Kiki 圆经理
医学客服经理/添加微信:mede1917






如果您和您的家人有任何医疗和新药需求,请欢迎随时联系我们。我们客服团队工作时间周一到周五早上9点到晚上8点,北京时间。
总部位于纽约,9年专注美国,是赴美就医服务细分领域的头部机构。 始终坚持精英式定制(非保姆式),获30+历史卡思克鲁力医生集团(全美TOP医生联盟)及股东战略产业投资,不涉及风险资本。 作为美国本土医疗资源提供商,美联医邦已与中国平安、泰康人寿、太平人寿等保险集团达成总对总合作。服务覆盖数百万保险客户。美国福布斯榜推荐和英文报道,直通全美前5%顶级专家网络。只精准对接全美72个专科排名TOP3医院,包括梅奥诊所、MD安德森、纪念斯隆-凯特琳癌症中心等百余家美国著名医疗机构。申请美国医院的折扣率10-30%,和美国医院议价能力高。3000+客户的信任选择,一切从用户角度出发,鼓励部分患者远程二诊/问诊拿方案在国内治疗,不过度宣传和劝退不必要的赴美看病。
了解更多美国美联医邦成都运营服务中心
Disclaimer 免责声明:
本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
纽约总部:
260 Madison Ave 8th Floor #8001,New York, NY 10016
美联医邦Medebound成都运营服务中心:
成都市锦江区红星路一段35号A区1号楼605
(美)+1 917-342-2381
(中) +86 400-616-2591
support@medebound.com