添加微信mede1917
或扫描二维码

添加微信mede1917
或扫描二维码

欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构


 美联医邦
美联医邦
文章类型: 美国新药和前沿
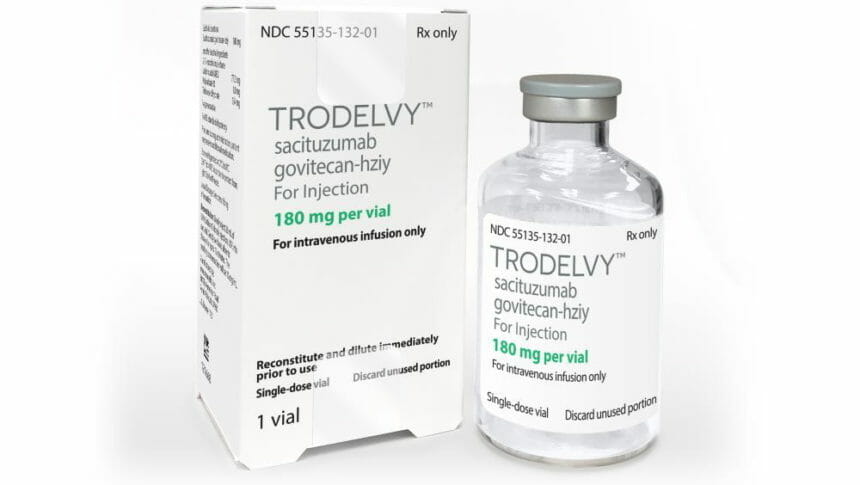
吉利德科学(Gilead)近日宣布,美国食品和药物管理局(FDA)已授予靶向抗癌药Trodelvy(sacituzumab govitecan-hziy,SG)完全批准,该药用于治疗:先前已接受过至少2种疗法、其中至少1种疗法治疗转移性疾病的不可切除性局部晚期或转移性三阴性乳腺癌(TNBC)成人患者。该批准将先前的加速批准转为了完全批准,同时扩大了先前的Trodelvy适应症,纳入了已接受过至少2种疗法、其中至少1种治疗转移性疾病的不可切除性局部晚期或转移性TNBC成人患者。而之前的适应症是:已接受过至少2种疗法治疗转移性疾病的转移性TNBC成人患者。
特别值得一提的是,Trodelvy是第一个可提高mTNBC患者无进展生存期(PFS)和总生存期(OS)的疗法,标志着TNBC治疗方面的一个重大进步。在3期ASCENT研究中,与化疗相比,Trodelvy将PFS显著延长(中位PFS:4.8个月 vs 1.7个月、疾病进展或死亡风险显著降低57%(HR=0.43,p<0.0001)、将OS显著延长(中位OS:11.8个月 vs 6.9个月)、死亡风险显著降低49%(HR=0.51,p<0.0001)。
ASCENT研究的全球首席研究员、哈佛医学院医学教授Aditya Bardia表示:“从历史上看,TNBC女性患者几乎没有有效的治疗选择,而且预后很差。今天FDA的批准,反映了里程碑式的ASCENT研究中统计学上显著的生存益处,并将Trodelvy定位为治疗TNBC的潜在新护理标准。”
Trodelvy是一款靶向Trop-2的新型、首创的抗体偶联药物(ADC),由靶向TROP-2抗原的人源化IgG1抗体与化疗药物伊立替康(一种拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成,药物-抗体比高达7.6:1。Trop-2是一种在许多上皮性肿瘤(包括TNBC)中频繁表达的细胞表面蛋白,在90%以上的TNBC中表达。Trodelvy与Trop-2靶向结合并递送抗癌制剂SN-38来杀死癌细胞。
Trodelvy由Immunomedics公司开发,其专有ADC平台的核心是使用一种新型的链接子,这种链接子不需要酶来释放有效荷载,可在肿瘤细胞内和肿瘤微环境中递送活性药物,从而产生近旁效应(bystander effect)。2019年4月,云顶新耀(Everest Medicines)与Immunomedics签订协议,获得了Trodelvy在大中华区、韩国、蒙古国、东南亚国家和地区的权益。2020年9月,吉利德以210亿美元收购Immunomedics,将Trodelvy收入囊中。
目前,Trodelvy已在美国上市。在欧盟方面,Trodelvy最近已进入加速评估。此外,Trodelvy治疗mTNBC在英国、加拿大、瑞士、澳大利亚的监管审查正在进行中。通过合作伙伴云顶新耀,Trodelvy治疗mTNBC也正在接受新加坡的监管审查。此外,Trodelvy的一份新适应症申请也正在接受美国FDA的审查:用于治疗先前在新辅助/辅助、转移性疾病中已接受过含铂化疗和PD-1抑制剂或PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌(UC)成人患者。
2020年4月,Trodelvy获得美国FDA加速批准,用于先前已接受过至少2种疗法治疗转移性疾病的mTNBC成人患者。值得一提的是,Trodelvy是FDA批准的第一个专门治疗复发或难治性mTNBC的ADC药物,也是FDA批准的第一个以Trop-2为靶点的ADC药物。该加速批准基于单臂多中心II期研究的总缓解率(ORR=33.3%)和缓解持续时间(中位DOR=7.7个月)数据。
此次完全批准,出国看病服务机构了解到基于3期ASCENT(NCT02574455)试验的结果。这是一项国际性、开放标签III期研究,共入组了500多例mTNBC患者,这些患者先前接受过至少2种疗法治疗转移性疾病。研究中,患者被随机分为2组,一组接受Trodelvy,另一组接受医生选择的化疗。主要终点是无进展生存期(PFS),次要终点包括总生存期(OS)、ORR、DOR、发生缓解的时间、安全性和耐受性。该研究是在FDA特别方案评估(SPA)下设计的,目的是验证Trodelvy在支持其批准的II期研究中所显示出的有希望的疗效和安全性。
结果显示,该研究达到了主要终点和关键次要终点:Trodelvy组与化疗组相比在PFS方面有统计学意义的显著改善(中位PFS:4.7个月 vs 1.7个月)、疾病进展风险显著降低57%(HR=0.43,95%CI:0.35-0.54,p<0.0001)。此外研究也达到了关键次要终点:Trodelvy组与化疗组相比在OS方面有统计学意义的显著改善(中位OS:11.8个月 vs 6.9个月)、死亡风险显著降低49%(HR=0.51;95%CI:0.41-0.62;p<0.0001)。此外,Trodelvy组与化疗组相比ORR也显著提高(35% vs 5%)。
TNBC治疗方面,2019年3月,罗氏PD-L1肿瘤免疫疗法Tecentriq(泰圣奇,通用名:atezolizumab,阿替利珠单抗)获美国FDA批准,联合化疗(Abraxane)一线治疗PD-L1阳性局部晚期或转移性三阴性乳腺癌(TNBC)患者。此次批准,使Tecentriq+Abraxane组合成为治疗TNBC的首个癌症免疫治疗方案。
2020年11月,默沙东Keytruda(可瑞达,通用名:pembrolizumab,帕博利珠单抗)获得美国FDA批准,联合化疗治疗肿瘤表达PD-L1(合并阳性评分[CPS]≥10)的局部复发性不可切除性或转移性三阴性乳腺癌(TNBC)患者。值得一提的是,这也是Keytruda在乳腺癌领域的首次批准。
Trodelvy(sacituzumab govitecan-hziy,SG)美国参考价格:2238.51美元/180mg
请联系我们获取美国专家建议和美国药物专案申请
附:Trodelvy(sacituzumab govitecan-hziy,SG)美国FDA使用说明
通用名:sacituzumab govitecan-hziy
商品名:Trodelvy
生产厂家:EMD Serono, Inc.
美国上市日期:2021-4
中国大陆未上市
警告:中性粒细胞减少症和腹泻
•可能发生严重的中性粒细胞减少症。对于绝对中性粒细胞计数低于1500/mm3或中性白细胞减少症,请暂不使用TRODELVY。在此期间定期监测血细胞计数治疗。考虑使用G-CSF进行二级预防。
立即开始对太阳镜性神经减少症患者进行抗感染治疗。
•可能会出现严重的腹泻。监测腹泻的患者并根据需要给予液体和电解质。如果没有禁忌,则给予阿托品用于严重程度的早期腹泻。在腹泻晚期时,应评估感染原因,如果为阴性,则应立即开始洛哌丁胺治疗。如果发生这种情况,请按住TRODELVY,直到解析为<1级并减少随后的剂量。
【作用机理】
Sacituzumab govitecan-hziy是Trop-2导向的抗体-药物偶联物。赛妥珠单抗是一种识别Trop-2的人源化抗体。小分子SN-38是拓扑异构酶I抑制剂,它通过接头共价附于抗体。药理学数据表明,sacituzumab govitecan-hziy与表达Trop-2的癌细胞结合,并通过连接子的水解作用与随后释放的SN-38结合。SN-38与拓扑异构酶I相互作用并阻止拓扑异构酶I诱导的单链断裂的重新连接,从而导致DNA损伤导致细胞凋亡和细胞死亡。在三阴性乳腺癌的小鼠异种移植模型中,Sacituzumab govitecan-hziy降低了肿瘤的生长。
【适应症】
TRODELVY是Trop-2定向抗体和拓扑异构酶抑制剂的缀合物,适用于治疗已接受过至少两种转移性疾病治疗的转移三联阴性乳腺癌(mTNBC)成年患者。
该适应症是根据肿瘤反应率和反应持续时间在加速批准下批准的。该指征的持续批准可能取决于验证性试验中对临床益处的验证和描述。
【用法用量】
•请勿将TRODELVY替代或与其他含药物的伊立替康或其活性代谢物SN-38一起使用。
•仅用于静脉输液。不要以静脉推注或推注的方式给药。
•在连续的21天治疗周期的第1天和第8天,每周一次的建议剂量为10mg/kg,直至疾病进展或出现不可接受的毒性。
•建议进行预防输液反应和预防化学疗法引起的恶心和呕吐的预防用药。
•在输注过程中以及输注完成后至少30分钟监视患者。可能需要中断治疗和/或减少剂量以控制不良反应。
•有关准备和管理说明,出国看病服务机构了解到请参阅完整的处方信息。
【剂量形式和强度】
注射用:将180mg冻干粉装入单剂量小瓶中,以进行重建。
【禁忌症】
对TRODELVY的严重超敏反应。
【不良反应】
mTNBC患者最常见的不良反应(发生率> 25%)为恶心,中性粒细胞减少,腹泻,疲劳,贫血,呕吐,脱发,便秘,皮疹,食欲下降和腹痛。
【警告和注意事项】
•超敏反应:已观察到超敏反应,出国看病服务机构了解到包括严重的过敏反应,并监测患者输注相关的反应。如果发生严重或危及生命的反应,则永久不连续使用TRODELVY。
•恶心/呕吐:在计划治疗时对3级恶心或3-4级呕吐的患者使用止吐药预防性治疗,并扣留TRODELVY。
•UGT1A1活性降低的患者:尿苷二磷酸-葡萄糖醛酸转移酶1A1(UGT1A)1*28纯合的个体在开始TRODELVY治疗后中性粒细胞减少的风险增加。
•胚胎-胎儿毒性:TRODELVY可能导致胎儿伤害。建议患者对胎儿有潜在危险,并采取有效的避孕措施。
【药物相互作用】
•UGT1A1抑制剂或诱导剂:避免同时使用。
【在特定人群中的使用】
•哺乳期:建议不要母乳喂养。
【包装供应/存储和处理方式】
TRODELVY(sacituzumab govitecan-hziy)注射剂是单剂量的无菌,灰白色至淡黄色冻干粉末。每个TRODELVY小瓶都单独装在纸箱中:
•NDC 55135-132-01包含一个180mg小瓶
将小瓶存放在原始纸箱中2°C至8°C(36°F至46°F)的冰箱中,出国看病服务机构了解到以防光照,直到重新配制为止。不要冻结
TRODELVY是一种细胞毒性药物。遵循适用的特殊处理和处置程序。
文章来源:
https://www.biopharmadive.com/news/gilead-immunomedics-trodelvy-full-approval-breast-cancer/598063/
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
![]()

美国美联医邦借助其30年历史的美国顶级名医网络,用便捷通道帮助国内患者接触到世界先进治疗方法,开展美国肿瘤罕见病名医视频咨询和新药申请,为生命续航。微信公众号:搜索“美联医邦”,贵宾热线:400-616-2591。客服微信: mede1917。
 签约中国平安泰康等保险巨头,覆盖200多万客户
签约中国平安泰康等保险巨头,覆盖200多万客户
 成功帮助1000+名患者
成功帮助1000+名患者
 100%成功境外支付,出国看病服务机构了解到95%患者好评率
100%成功境外支付,出国看病服务机构了解到95%患者好评率
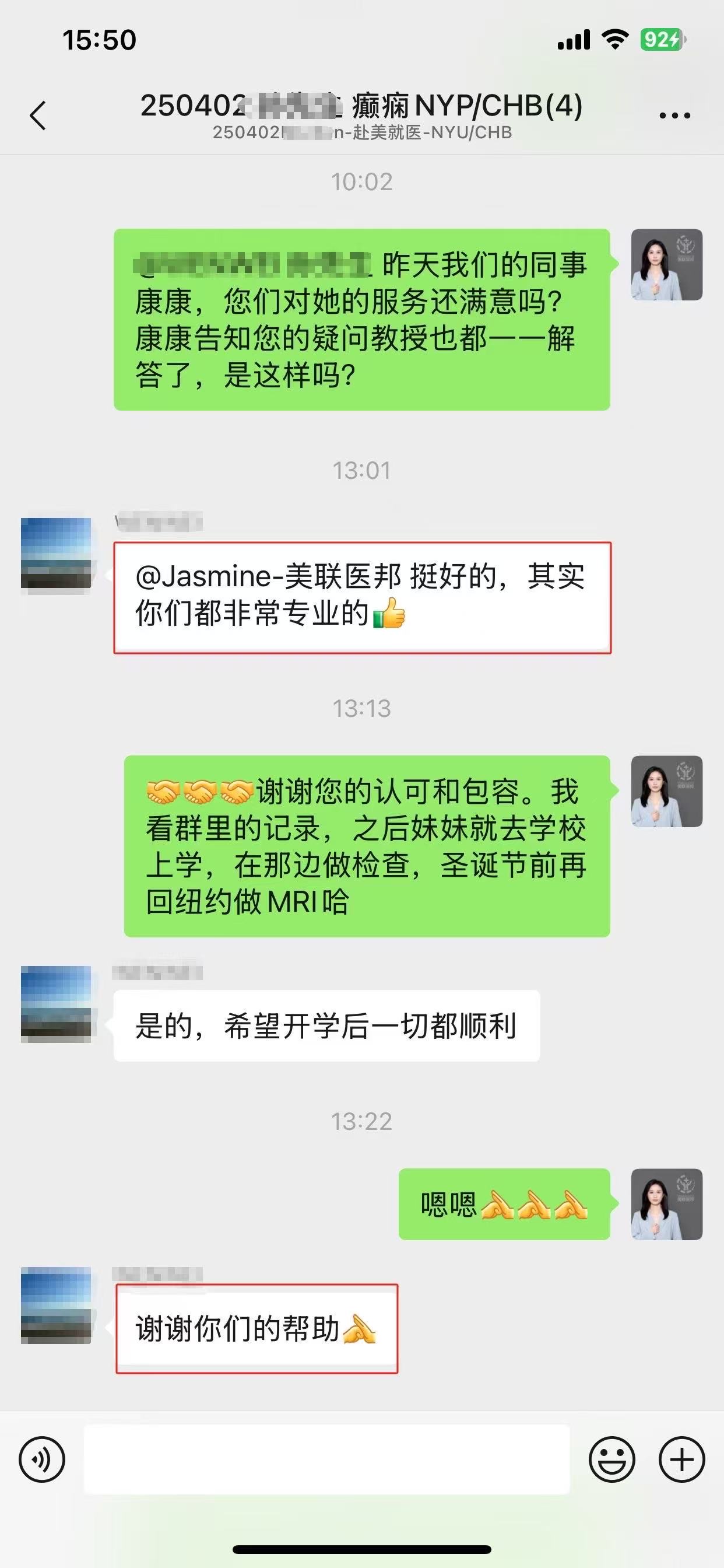
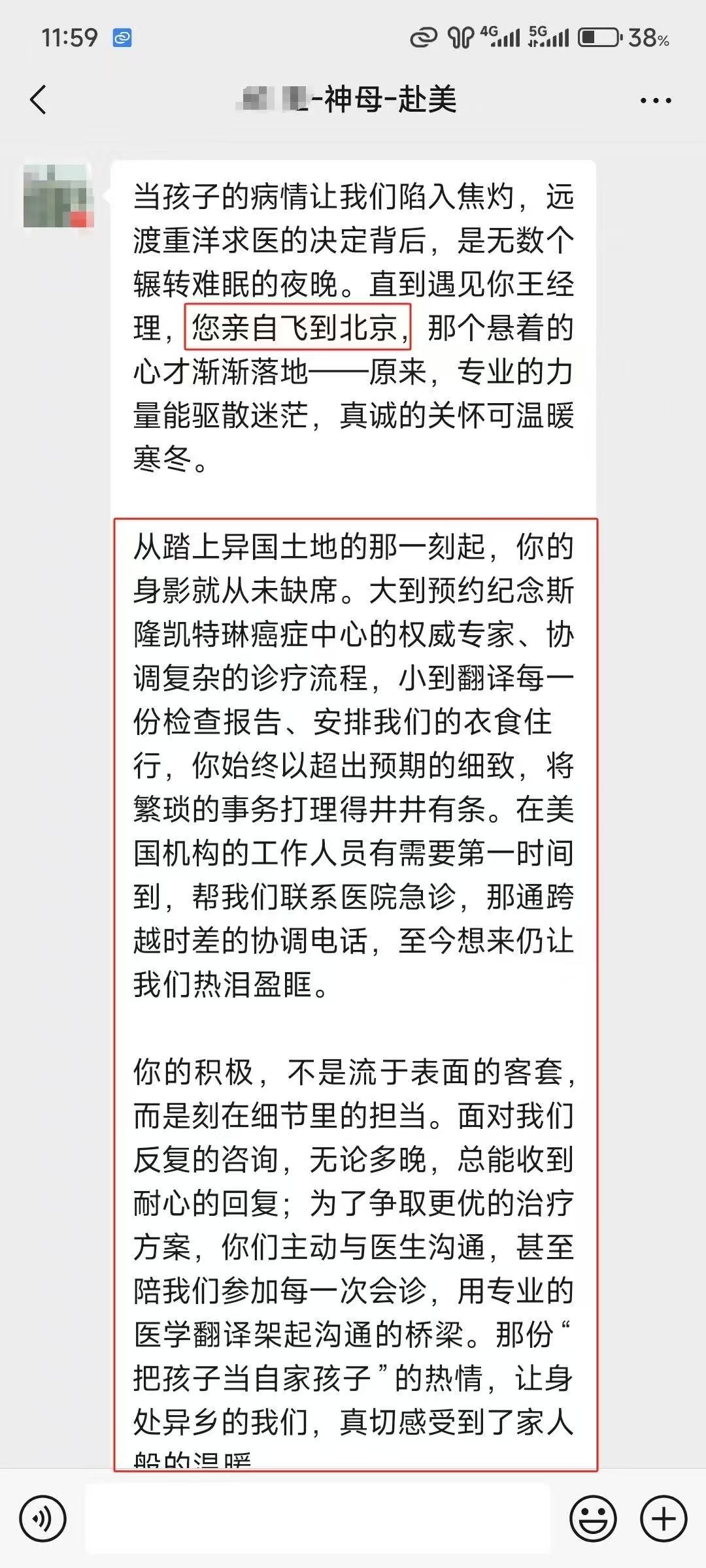
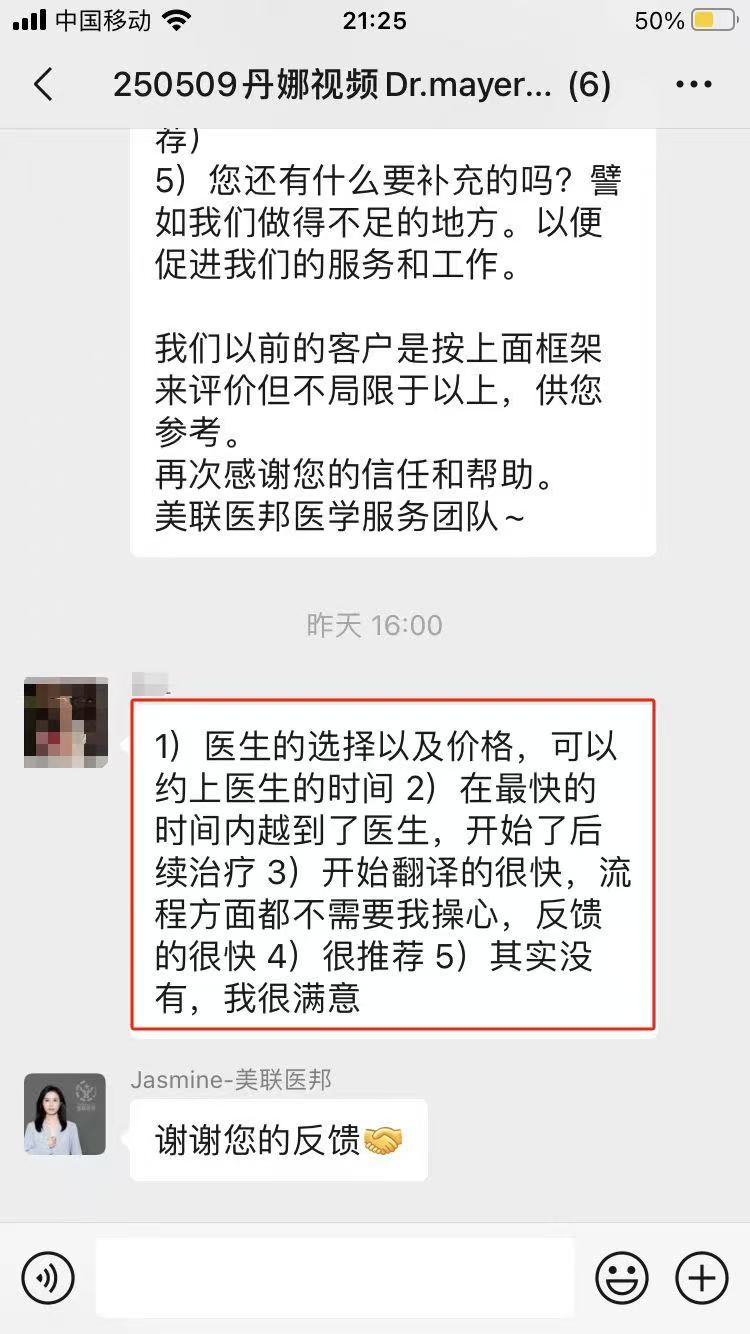
相似【案例】
☞国内患者远程咨询美国排名前三癌症中心斯隆凯瑟琳,出国看病服务机构了解到获美国最新肺癌新药
部分美联医邦美国名医真实案例
☞美国美联医邦|Medebound与中国保险巨头泰康人寿正式签约
☞膀胱癌患者通过视频会诊中美两国三地联线哈佛名医,出国看病服务机构了解到寻求治疗方案及临床试验建议
☞美国约翰霍普金斯医院专家视频远程为白血病患者提出治愈性方案
凭借我们30多年的美国医疗网络资源,您可以直接与美国医疗精英对话,在家中咨询美国顶级专家或国际会诊,不出国门获取先进治疗方案。
凭借我们30年的医疗网络资源,您可以直接与美国医疗精英对话。在家中咨询疑难疾病的专家,轻松了解治疗方案。
如需赴美就医或获取海外新药,我们为您一站式安排海外看病等服务。



服务优势
预约知名美国专家譬如安德森癌症医院和梅奥诊所,安排无忧出国看病行程,寻找全球新药新技术医生网络
我们与美国顶级1%的海外医疗医生网络,300+所美国权威医院和药房资源深度合作一站式海外诊疗我们的专属客服医学经理,为您免费咨询,最短时间获取预约优质医疗资源

Jason 王经理
医学客服经理/添加微信:Mede2018

Kiki 圆经理
医学客服经理/添加微信:mede1917






如果您和您的家人有任何医疗和新药需求,请欢迎随时联系我们。我们客服团队工作时间周一到周五早上9点到晚上8点,北京时间。
总部位于纽约,9年专注美国,是赴美就医服务细分领域的头部机构。 始终坚持精英式定制(非保姆式),获30+历史卡思克鲁力医生集团(全美TOP医生联盟)及股东战略产业投资,不涉及风险资本。 作为美国本土医疗资源提供商,美联医邦已与中国平安、泰康人寿、太平人寿等保险集团达成总对总合作。服务覆盖数百万保险客户。美国福布斯榜推荐和英文报道,直通全美前5%顶级专家网络。只精准对接全美72个专科排名TOP3医院,包括梅奥诊所、MD安德森、纪念斯隆-凯特琳癌症中心等百余家美国著名医疗机构。申请美国医院的折扣率10-30%,和美国医院议价能力高。3000+客户的信任选择,一切从用户角度出发,鼓励部分患者远程二诊/问诊拿方案在国内治疗,不过度宣传和劝退不必要的赴美看病。
了解更多美国美联医邦成都运营服务中心
Disclaimer 免责声明:
本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
纽约总部:
260 Madison Ave 8th Floor #8001,New York, NY 10016
美联医邦Medebound北京国际会诊中心:
北京市东城区天坛南里12号医疗机构
美联医邦Medebound成都运营服务中心:
成都市锦江区红星路一段35号A区1号楼605
(美)+1 917-342-2381
(中) +86 400-616-2591
support@medebound.com